- 029-86354885
- 18392009562
內容提要
硝酸還原酶(nitreductase, NTR)在缺氧**中可能過表達,因此選擇性、高效地檢測NTR具有重要意義。雖然已經有一些光學方法用于檢測溶液中的NTR,但仍缺乏有效的光學探針來監測體內NTR。因此,本文報道了一種用于NTR的近紅外(NIR)熒光檢測探針。在5種具有不同硝基芳香基團修飾的熒光報告結構的近紅外花菁染料(Cy7-1?Cy7-5)的基礎上,篩選出對硝基苯甲酸基修飾的花菁探針(Cy7-1)可以作為NTR的快速近紅外熒光增強探針監測和生物成像。理論研究揭示了連接檢測和熒光報告基團和硝基位置的連接劑是氫鍵形成和空間結構匹配的關鍵因素,誘導NTR催化能力增強。當Cy7-1被NTR催化還原為Cy7-NH2時,會阻斷吸電基團誘導的電子轉移過程,表現為檢測過程中熒光強度增強。缺氧A549細胞的共聚焦熒光成像證實了Cy7-1在細胞水平的NTR檢測能力。Cy7-1可以在小鼠缺氧**模型中檢測**缺氧,顯示出快速顯著增強其適合熒光生物成像的近紅外熒光特性。

前言
缺氧是**組織的一個特征,在臨床應用中,微血管異常的缺氧**的形成會限制細胞毒性化療藥物在其中的灌注,與常氧**相比,降低其療效。因此,評估**缺氧程度對預測**療效具有重要意義。到目前為止,已經發展了幾種評估**缺氧程度的方法,如氧壓測量法(如氧電極法)、血流速度法(如血氧合水平依賴性磁共振成像(blood - MRI))、缺氧標志物檢測法(如硝基還原酶、缺氧誘導因子(HIF)等生物標志物檢測具有較高的選擇性和敏感性,是缺氧檢測的一種重要方法。一般來說,缺氧伴隨著還原酶水平的升高,如硝基還原酶(NTR)、二磷酸脫氫酶和偶氮還原酶。在實體瘤中,NTR水平與缺氧程度直接相關。因此,NTR水平的檢測可用于評價**缺氧程度。NTR的催化反應,芳香底物與NTR之間由于氫鍵作用、π?π堆疊作用、疏水效應等相互作用較強,表現出較高的反應活性。底物中的硝基可以先還原為亞硝基,然后再還原為羥胺基,最后還原為氨基。此外,吸電子基團引起電子轉移過程,使底物的熒光發射猝滅,NTR還原硝基導致熒光強度的變化,這是NTR檢測熒光探針設計的重要策略。文獻報告了幾種將芳香硝基與可見激發熒光團(如萘酰亞胺、尼羅河藍和間苯二酚)連接起來的熒光探針,這些探針需要紫外線(UV)或可見光作為激發源,可能對健康細胞和器官造成有害影響。最近,Tang的研究小組報告了一種花菁衍生物作為近紅外(NIR)熒光開啟探針來檢測NTR,但是沒有進行體內動物生物成像。因此,開發一種有效的用于體內成像的NTR光學探測探針仍然是一個重大的挑戰。作者在5個以硝基芳香基裝飾的花菁探針(Cy7-1?Cy7-5, 圖1)研究的基礎上,系統地研究了Cy7-1在NTR檢測中的研究。Cy7-1具有快速響應、超靈敏和激發和發射波長均位于近紅外光學窗口。建立其在體外缺氧細胞中檢測過表達硝基還原酶的能力,并應用于體內熒光生物成像技術監測**內NTR。
結果與討論
在本研究中,檢測部分和熒光報告單元分別為芳香硝基和花菁結構。為了優化探針結構,我們選擇了不同的連接基團和不同的硝基位置來研究探針的構效關系。如圖1所示,通過固定對硝基苯基和花菁基,將連接鍵由?COO變為O和S,得到的探針Cy7-1、Cy7-2和Cy7-3可以看出連接鍵的影響。然后通過固定酯鍵連接花菁部分和芳香基團,將硝基從對苯基位置引入鄰苯基位置和間苯基位置,得到探針Cy7-2和Cy7-3,并探討芳香硝基位置的影響。由于芳香硝基具有很強的吸電子性,可以認為這些探針的熒光可以被猝滅。與NTR反應后,硝基被還原,從而抑制了分子內電子轉移過程,這對應于花菁的熒光發射恢復。如圖1種探針的吸收光譜和熒光發射光譜,在730 nm激發下,除了Cy7-2紅移約20 nm外,這些探針顯示出類似的近紅外發射帶。但是,Cy7-1?5在Tris緩沖溶液中的絕對量子產率分別為<0.1%、<0.1%、1.1%、<0.1%和0.3%,表明吸電子基團誘導的電子轉移過程抑制了熒光發射。在NADH存在的情況下,添加0.25 μg mL?1NTR時,探針Cy7-2?5的熒光強度沒有明顯變化,但Cy7-1的熒光強度顯著增強了約110倍。為了鑒定NTR還原硝基轉化為氨基物質的增強熒光,合成了Cy7-NH2的還原產物。Cy7-NH2與Cy7-1具有相似的近紅外發射帶,但其熒光強度比Cy7-1高2個數量級。質譜/液相色譜進一步證實 Cy7-1在NADH存在下與NTR反應形了Cy7-NH2。
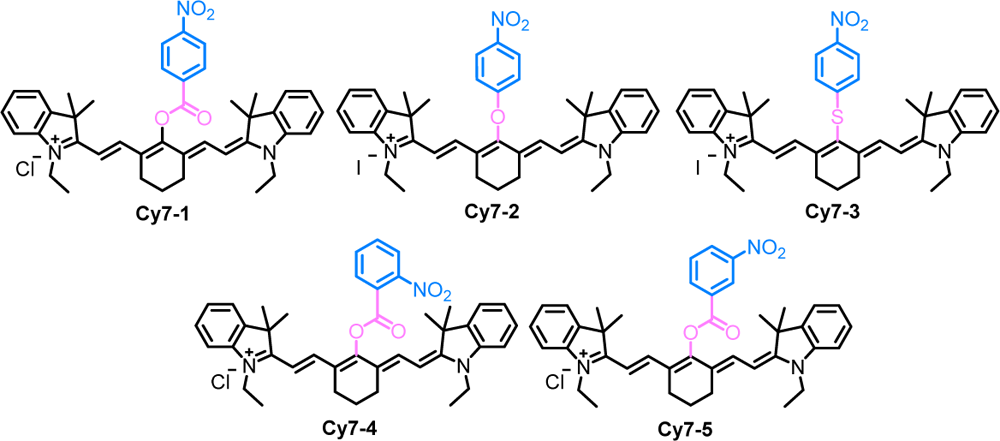
圖1. 五種熒光探針Cy7-1?5的化學結構。Cy7-1?5的紫外-可見吸收光譜(a)和歸一化熒光發射光譜(b)在0.05 M Tris緩沖液中,1.5% DMSO為共溶劑,pH = 7.4。
為了深入了解結構與NTR檢測能力之間的關系,對Cy7-1?Cy7-5與硝基還原酶進行對接計算。探針分子通過疏水作用和芳香環π-π相互作用趨向于NTR的疏水空隙,然后利用NTR氨基酸殘基與Cy7-1的硝基O原子之間的氫鍵形成過渡態。帶有對取代硝基的探針Cy7-1與NTR的Ser12、Ser14、Arg10、Arg11和Arg 172氨基酸殘基形成8個氫鍵。相比之下,Cy7-2?Cy2-5中只有1、2、2和4個氫鍵形成。我們將Cy7-2,Cy7-3與NTR的相互作用可視化,以研究Cy7-1中連接鍵?COO基團的影響。Cy7-2和Cy7-3的O原子和S原子與NTR氨基酸殘基之間沒有形成氫鍵,而Cy7-1與?COO形成了一個氫鍵鏈接器組。此外,Cy7-2或Cy7-3的空間排列與親水空間匹配不佳,在硝基和氨基酸殘基之間只形成了一到兩個氫鍵。與之形成鮮明對比的是,Cy7-1的硝基O原子與NTR的氨基酸殘基之間有7個氫鍵,表明Cy7-1與NTR的空間結構匹配最優。這證明了探測部分與熒光報告部分之間的連接是探針探測部分從疏水空間到親水空間空間結構匹配的關鍵因素。將酯連接鍵固定在探針結構上,通過比較Cy7-4、Cy7-5和Cy7-1含有鄰硝基和間硝基的探針和Cy7-1含有對硝基的探針,觀察了硝基位置對探針結構的影響。Cy7-4和Cy7-5的硝基O原子和氨基酸殘基之間只有2和3個氫鍵,而Cy7-1的氫鍵則遠遠少于7個。我們分析了化學結構,可以發現,Cy7-1、Cy7-4、Cy7-5的硝基O原子與熒光報告菁部分的距離分別為8.33和8.66 ?、4.87和2.76 ?、6.2和7.66 ?。因此,硝基O原子與熒光報告部分之間的距離較長,有利于探針接近NTR親水部分的氨基酸殘基并與之形成強氫鍵。這一事實也有助于增強Cy7-1的空間結構匹配和NTR催化能力。Cy7-1在檢測部分和熒光報告部分之間的連接和硝基位置的重要性,并解釋Cy7-1具有極高的反應活性和靈敏度。
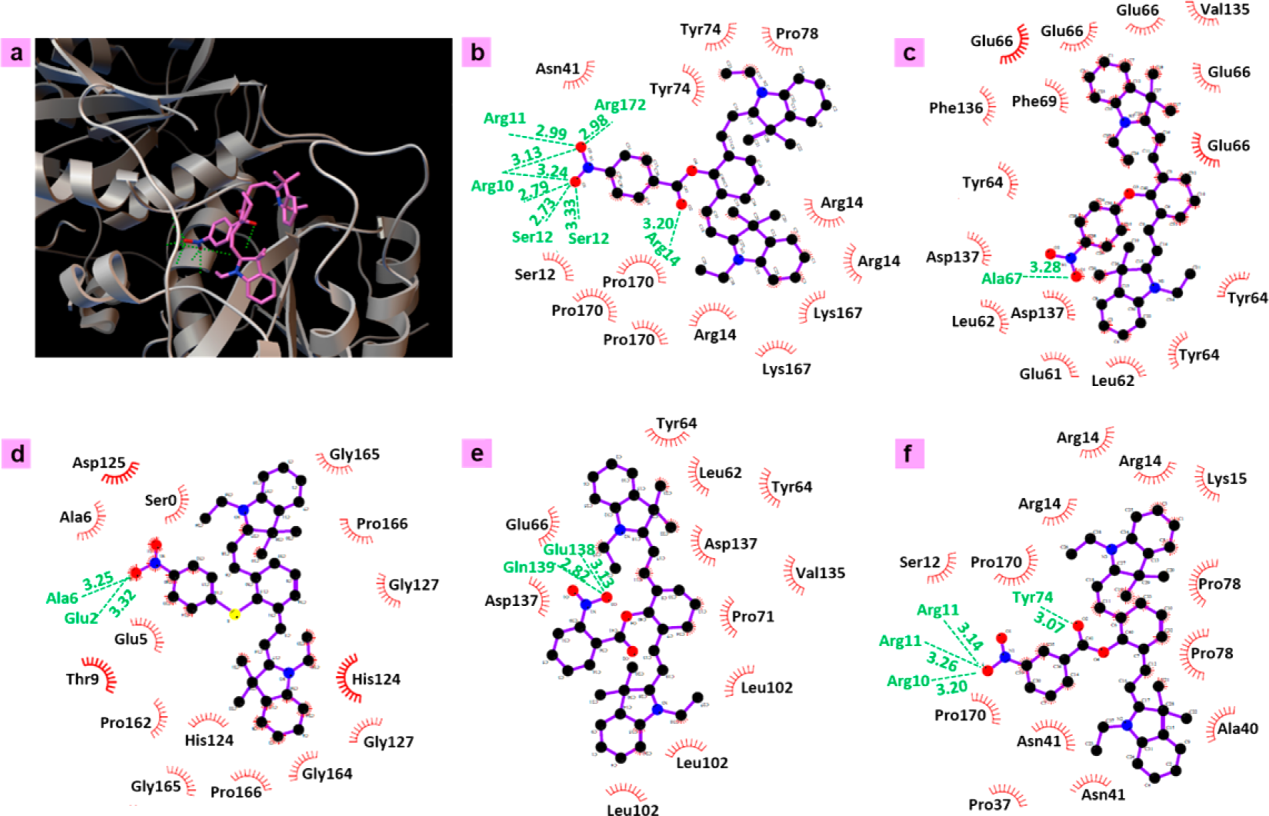
圖2. Cy7-1 (a, b)、Cy7-2 (c)、Cy7-3 (d)、Cy7-4 (e)、Cy7-5 (f)與NTR結合的計算模型。在(a)中,Cy7-1結構的C、N和O原子分別顯示為粉紅色、藍色和紅色。在(b - f)中,Cy7-1到Cy7-5的C、N和O原子分別顯示為黑色、藍色和紅色。紅色曲線表示NTR的疏水區和氨基酸殘基。氫鍵用綠色虛線表示。
如圖3b所示,在加入NTR后的1 min內,熒光發射掃描顯示出顯著的增強,說明對酶的響應非常快。隨著NTR濃度的增加,達到最大熒光強度所需的時間逐漸縮短(圖3c)。酶濃度的增加提高了其催化能力,加速了含硝基探針對熒光胺的還原。最大熒光強度隨著NTR濃度的增加而增加,如圖3d所示。這表明光強可以直接反映NTR濃度。在優化的反應條件下(pH≈7.4,溫度= 3.7°C),合成了一種具有較好活性的NTR降低Cy7-1的熒光強度,NTR濃度在0.15~0.45 μg mL?1范圍內呈良好的線性關系。檢測限為NTR的1.14 ng mL?1。即使在pH 6.0和室溫(25℃)的非優化條件下,NTR仍能催化Cy7-1的還原,發射強度在30 s內迅速增強,并在10 min以上繼續增強。為了進一步研究Cy7-1的反應選擇性,研究了鹽(K+、Na+、Ca2+)、氨基酸(酪氨酸、甘氨酸、谷氨酸、色氨酸、精氨酸)、葡萄糖、維生素C、活性氧(H2O2、KO2)、溶菌酶、BSA等潛在干擾物種。在500 μM NADH存在下,將這些潛在干擾物質添加到Cy7-1 (10 μM)中,沒有觀察到顯著的熒光增強。此外,對氧化還原系統中的一些干擾物種如電子轉運體(細胞色素b5、細胞色素c)和氧化還原酶(亮氨酸脫氫酶、谷胱甘肽還原酶和甲酸脫氫酶)也具有很高的選擇性。
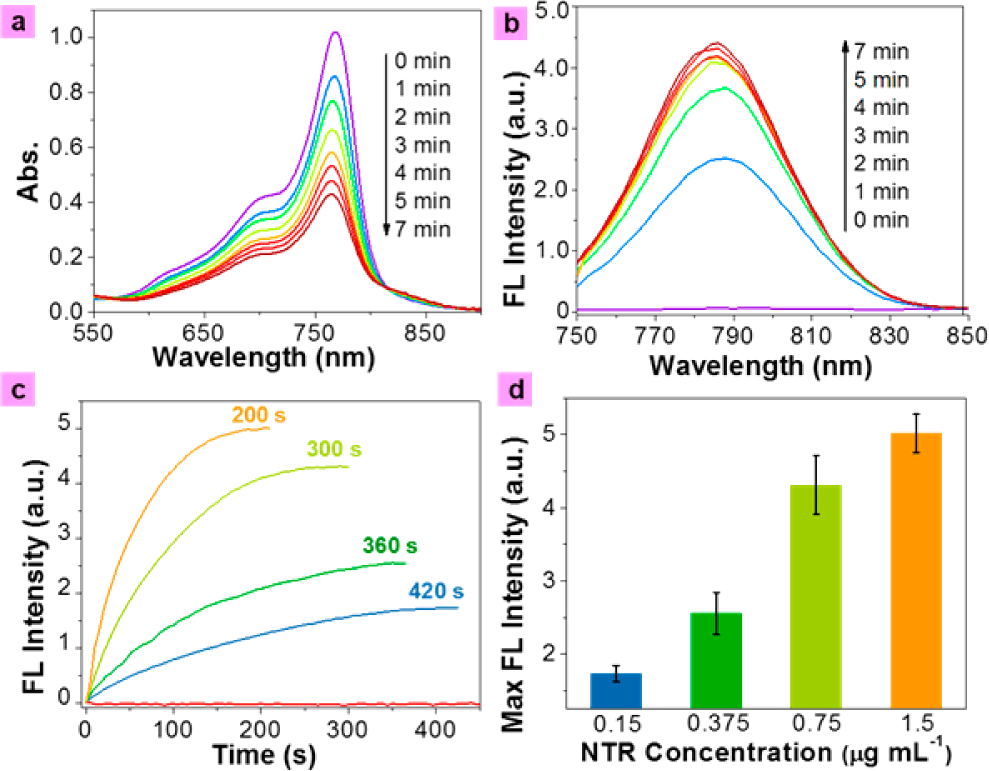
圖3. (a?b) Cy7-1 (10 μM)的紫外-可見吸收(a)和熒光(b)光譜掃描與NTR (0.25 μg mL?1)反應。(c)當NTR濃度為0.15 μg mL?1(藍色)、0.375 μg m L?1(綠色)、0.75 μg m L?1(黃色)、1.5 μg mL?1(橙色)和不含NTR(紅色)時,Cy7-1 (10 μM)的熒光發射強度(λex= 730 nm、λem= 782 nm)隨時間變化。(d)不同NTR濃度催化Cy7-1 (10 μM)的最大發射強度。
采用MTT法測定Cy7-1對A549細胞系(人肺泡基底上皮細胞)的細胞毒性。Cy7-1在2 ~ 25 μM濃度下孵育6或12 h,細胞存活率為>70%,具有較低的毒性。為了評估Cy7-1在細胞內NTR監測中的適用性,共聚焦熒光顯微鏡對A549細胞進行了檢測,該細胞已知在缺氧條件下表達NTR。A549細胞在常氧條件(20% O2)和不同缺氧條件(10%、5%、3%和1% O2)下培養6 h,然后用5 μM Cy7-1處理10分鐘。如圖4所示,常氧條件下培養的A549細胞顯示出非常微弱的近紅外熒光信號。然而,A549細胞在低氧濃度下培養時,近紅外區域熒光信號增強,說明這些細胞在不同氧濃度下可以表達不同的NTR濃度。表達的NTR可催化還原探針Cy7-1,使其在不同缺氧條件下培養的細胞中熒光強度增加。
圖4. Cy7-1 (5 μM)孵育不同氧濃度條件下A549細胞的共聚焦熒光顯微鏡成像。(a)在近紅外通道(780±30 nm, λex= 633 nm半導體激光器)采集熒光成像。(b)合并熒光成像和亮場成像。比例尺= 60 μm。
將Cy7-1在Tris緩沖液中直接注射到活小鼠的A549**中,在730 nm(功率密度為1 mW cm?2)連續激發下,收集800±12 nm的信號。為了動態觀察Cy7-1在小鼠**內注射前后熒光強度的變化,在小鼠旁邊放置裝有Cy7-1 (20 μM)的Tris緩沖液管(圖5a)。在長期跟蹤中,管中的Cy7-1基本上是不發射的。注射Cy7-1后,**區域(d = 12 mm) 2 s內熒光強度顯著增強,3 min內注射部位熒光強度達到最高(約8倍),如圖5b, 5c所示。隨著追蹤時間的延長,熒光強度的增加逐漸從注射部位擴散到整個**區域。如之前證實的,將Cy7-1探針注入**后,**產生的NTR催化將其還原為Cy7-NH2,使整個**產生熒光,熒光持續時間超過30分鐘。為了在體內研究其抑制作用,作者選擇雙香豆素作為NTR的抑制劑。在**區域注射Cy7-1和雙香豆素混合物時,熒光強度的增強程度(5倍)明顯低于未注射雙香豆素時的增強程度(8倍)。首先將雙香豆素注射到**的一半區域,10 min后再注射Cy7-1,進一步抑制了熒光增強。實際上,在注射雙香豆素的**區域沒有觀察到進一步的熒光增加(約0.3倍),這種抑制進一步證實了NTR在**中催化還原Cy7-1到發射cy7NH2。
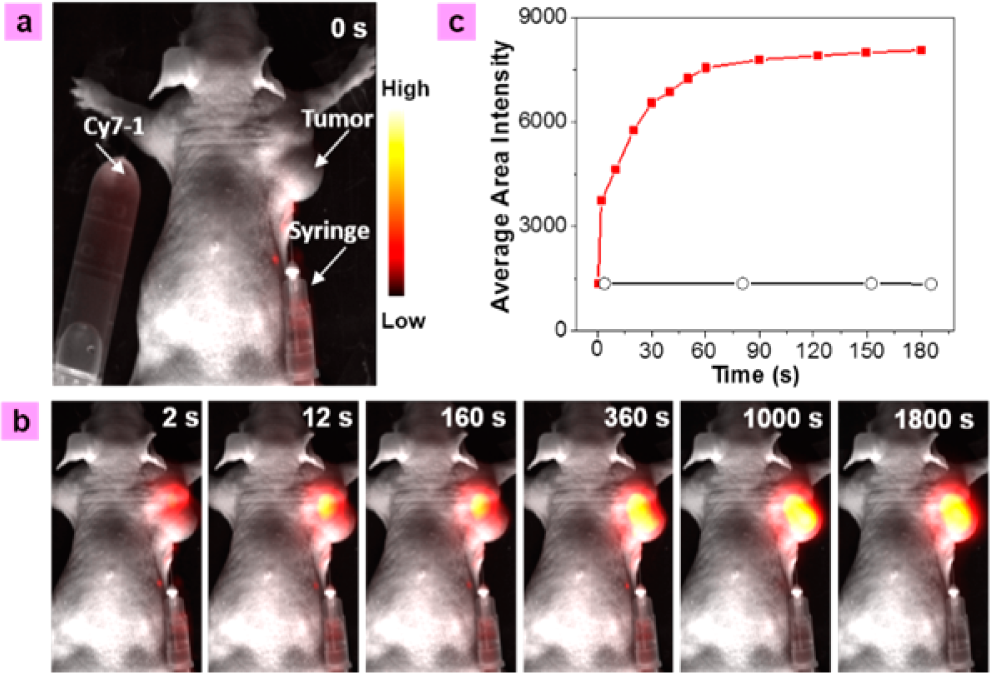
圖5. A549**小鼠模型在**內注射Cy7-1 (20 μM, 100 μL)前(a)和(b)后的基于時間的體內熒光成像。(c)注射后0 ~ 180 s, Cy7-1在試管(黑色)和小鼠**區(紅色)中的熒光強度變化。在730 nm連續激光(功率密度為1 mW cm?2)激勵下,λem= 800±12 nm采集熒光信號。
PET技術已被廣泛用于區分缺氧和常氧**,基于18F-FMISO可以與**過表達NTR的事實。如圖6a所示,在A549荷瘤小鼠體內靜脈注射18F-FMISO (300 μCi, 0.9% NaCl水溶液,0.2 mL) 90 min后,在**區域觀察到強烈的18F信號。PET成像完成后,將小鼠解剖。A549**組織(檢測樣本)和A549**旁的正常組織(對照樣本)進行電泳酶檢測,遷移的正常A549**的關系(2)是一樣的,正常標記(3)關系的SDS?PAGE,酶分子量24 kDa,可比與標準蛋白(4)。相比之下,沒有相同的酶或蛋白分子量從正常組織獲得(1)。一般情況下,隨著**體積的增大,缺氧程度加重,NTR的過表達增多探針Cy7-1也被用來監測NTR在不同大小的A549**(1,d = 7 mm, 2, d = 12 mm)中的過表達程度。如圖6b,6c所示,小鼠1 (7 mm**)和小鼠2 (12 mm**)**區域的熒光信號分別增強了3倍和8倍左右。這些明顯的熒光增強反映了不同大小**中不同程度的缺氧。因此,Cy7-1為體內監測**NTR過表達和缺氧水平提供了一種潛在的工具。如圖9d,我們也得到了相同的酶檢測結果,并對圖6b中小鼠1(左)的光學成像進行了驗證。
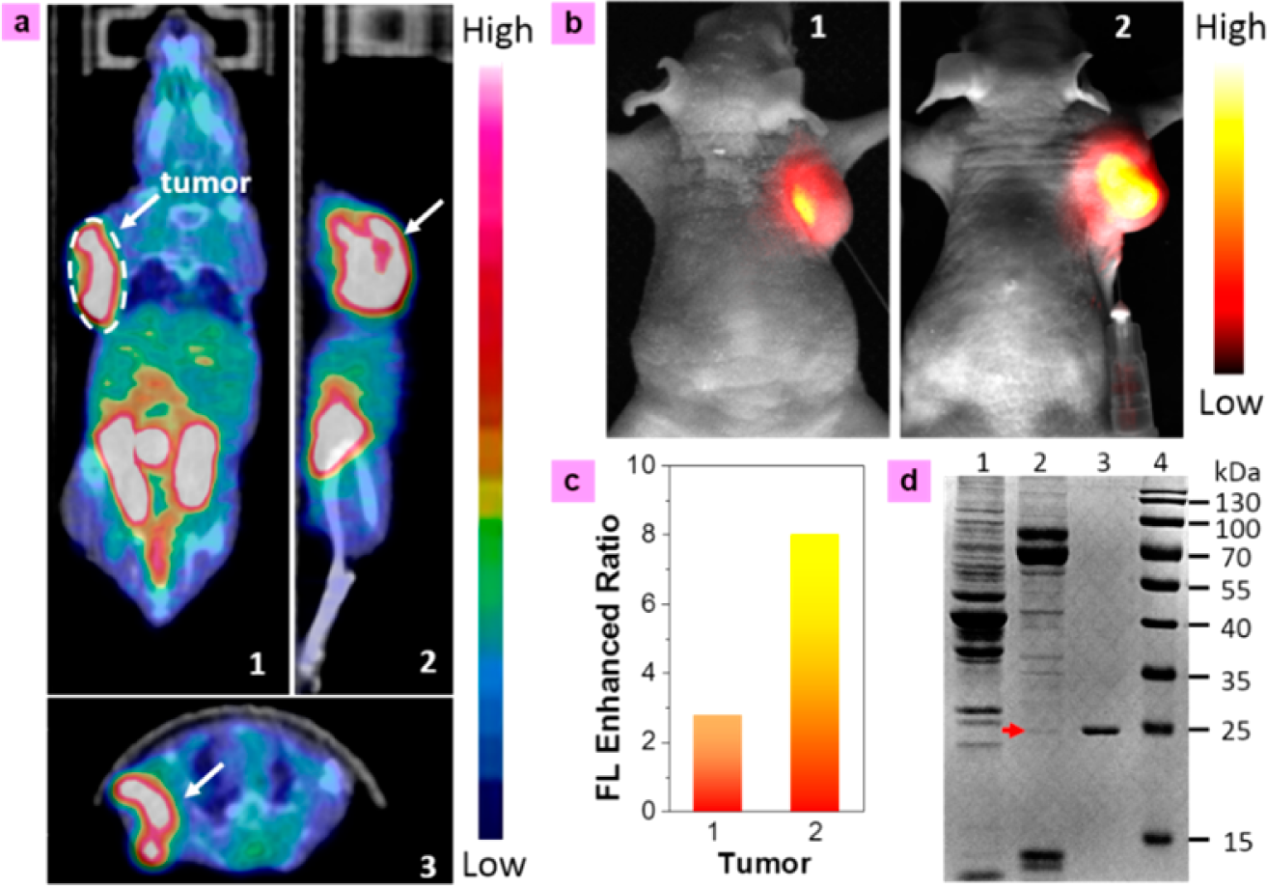
圖6. (a)靜脈注射18f - fmiso (300 μCi, 0.9% NaCl aq.溶液,0.2 mL) 90min后的A549瘤小鼠(**,d = 12 mm)的PET/CT顯像(1)冠狀面,(2)矢狀面,(3)橫切面。(b)體內熒光成像的A549**?軸承小鼠模型(左**1到7毫米,右**的第2到 12毫米)通過**注射注入20 μM Cy7-1 0.05 mM Tris緩沖液的解決方案(100 μL) 5分鐘后收集到的熒光信號在800±12 nm,730 nm輻照功率密度為1 mWcm?2。(c) 老鼠(b)中A549**的**區域熒光提高比率。(d) 左老鼠1 (b)的酶檢測結果。 (1):A549**樣本旁邊的正常組織;(2):A549**組織樣本;(3):正常標記關系;(4)蛋白質分子量標準。
作者選擇小鼠急性腹膜炎模型來研究Cy7-1與活性氧的體內相互作用。與正常小鼠相比,急性腹膜炎小鼠出現了嚴重的腸腔水腫和充血。在腹腔注射Cy7-1后的較長時間內,整個腸-腹腔區域均未觀察到明顯的熒光增強,而在**區域則有8倍的熒光增強(圖7)。因此,Cy7-1是一種新的近紅外探針,可以通過體內生物成像來區分缺氧**和炎癥組織。以Cy7-1為探針,用人工組織對生物成像的穿透深度進行了研究。當激光激發功率密度固定在1 mW cm?2時,熒光強度隨著人工組織厚度的增加而降低。當激發功率強度增加,人工組織厚度設置為6mm時,可以監測到信號,信噪比增加到3左右。說明Cy7-1具有良好的光穿透深度和較低的近紅外激發功率密度,可作為一種優良的生物成像探針。
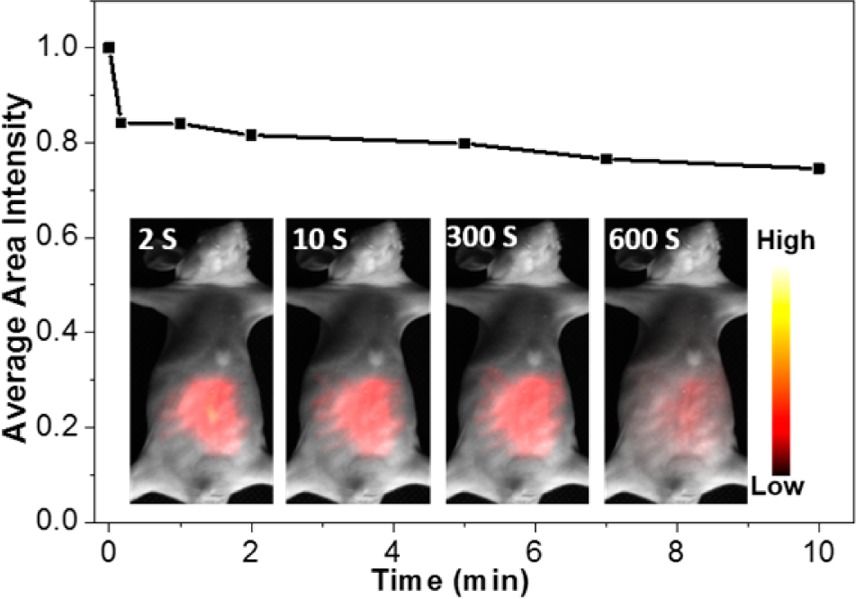
圖7. Cy7-1 (20 μM, 200 μL)注射急性腹膜炎模型小鼠后熒光強度的變化。插圖: 通過腹腔注射注入模型小鼠的Cy7-1的基于時間的體內熒光成像。在730 nm連續激光
序號
新聞標題
瀏覽次數
作者
發布時間
1
抗氧化小分子70831-56-0,菊苣酸Cichoric Acid,6537-80-0的制備過程
741
瑞禧生物
2023-03-30
2
活性氧ROS小分子Dapsone,cas:80-08-0,氨苯砜的制備過程-瑞禧科研
659
瑞禧生物
2023-03-30
3
HBPS-N3,Azide-PEG-HBPS,疊氮化超支化聚苯乙烯高分子聚合物的制備過程
769
瑞禧生物
2023-03-17
4
l-PS-PhN3,Azide疊氮Azido偶聯線性聚苯乙烯雙鏈的制備過程
716
瑞禧生物
2023-03-17
5
N3-PS-N3,Azido-PS-Azido/Azide,雙疊氮官能團修飾聚苯乙烯的制備方法
674
瑞禧生物
2023-03-17
6
PS-N3,Azido-PS,疊氮Azide修飾聚苯乙烯/高分子聚合物的制備過程
847
瑞禧生物
2023-03-17
7
Azido-PEG2-t-Butylester/1271728-79-0,疊氮N3/ZAD修飾叔丁酯化合物的制備方法
688
瑞禧生物
2023-03-14


 400-115-0588
400-115-0588 在線咨詢
在線咨詢







 庫存查詢
庫存查詢