產品分類
快速訂購
31952518
- 029-86354885
- 18392009562
sales@xarxbio.com
首頁 > 資料專欄

內容提要
本文構建了一個負載羰基鐵簇合物的納米平臺(FeCORM NPs),通過化學動力學治療(CDT)和免疫原性細胞死亡(ICD)誘導的免疫治療,對黑色素瘤的肺轉移表現出優異的療效。羰基鐵簇合物納米粒子可由谷胱甘肽(GSH)和過氧化氫(H2O2)引發,通過配體交換和氧化還原破壞途徑釋放CO并生成亞鐵鹽,釋放的CO導致線粒體損傷,而生成的亞鐵鹽通過Fenton反應導致氧化應激。另一方面,納米材料誘導基于ICD的免疫治療,與CDT共同作用,通過小鼠模型顯示出極好的抗黑色素瘤肺轉移效果。這項工作構建一個簡單穩定的納米平臺,利用**中相對較高水平的GSH和H2O2來啟動治療效果,從而使納米平臺能夠區分正常細胞和**細胞。該系統不僅在治療黑色素瘤的肺轉移,而且在抑制其他類型的**轉移。前言
惡性黑色素瘤(MM)是一種來源于皮膚黑色素細胞的惡性**,很容易擴散到淋巴結、肝、肺、腦和其他器官。肺是其最常見的遠處轉移靶點。一旦發生轉移,其預后和治療都會很困難。為了提高黑色素瘤肺轉移的生存率,需要更有效、更特異的治療策略,盡管這些策略具有挑戰性。免疫原性細胞死亡(ICD)越來越被認為是一種細胞死亡途徑,已成為癌癥免疫治療(IMT)的策略之一。基于外部刺激的療法,如光動力療法(PDT)、放射療法(RT)、光熱療法(PTT)。然而,基于**微環境(TME)等內部刺激誘導ICD具有挑戰性。作為一種微創治療策略,化學動力學療法(CDT)是一種通過芬頓反應產生高度細胞毒性活性氧(ROS)(例如:·OH、1O2和O2·–)的有前景的TME反應性治療。癌細胞中高于毒性閾值的ROS水平可能壓倒抗氧化系統,并啟動ICD以調節死亡癌細胞的免疫原性,這是一種更好的協同治療策略。因此,需要設計單一成分的平臺,使用內源性刺激誘導和增強ICD,而癌癥IMT的療效不會受到影響。在此,我們報告了一種新的納米平臺(FeCORM NPs),即負載有二鐵六羰基化合物(FeCORM)的納米顆粒,該納米顆粒不含額外成分且對TME具有響應性。在組裝過程中,采用聚苯乙烯-馬來酸共聚物-聚(乙二醇)-聚(乙二醇)(PSMA-PEG)作為載體,通過載體與鐵羰基化合物之間的疏水作用來負載FeCORM NPs,從而形成納米顆粒。FeCORM NPs可與過氧化氫(H2O2)和谷胱甘肽(GSH)反應生成活性氧(ROS)并在癌細胞中釋放一氧化碳(CO),從而誘導CDT和ICD誘導IMT,在體內對黑色素瘤的肺轉移顯示出良好的效果。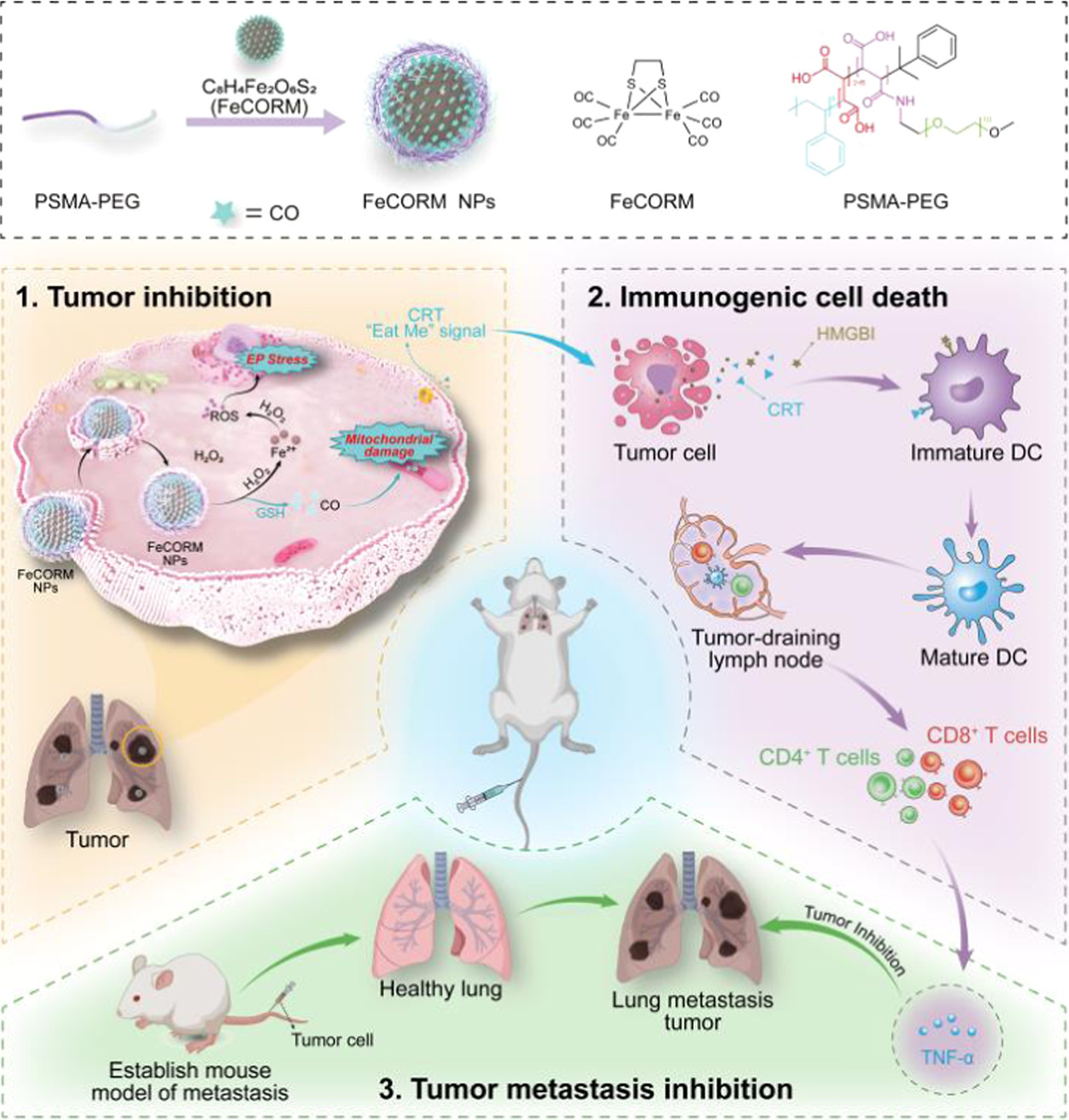
FeCORM 納米粒子及其治療效果形成的示意圖。
結果與討論
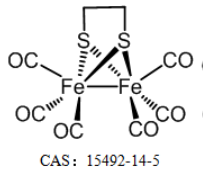
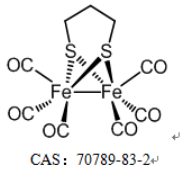
FeCORM NPs通過鐵羰基絡合物(FeCORM,C8H4Fe2O6S2或[Fe2(μ-SCH2)2(CO)6],和聚苯乙烯-馬來酸鈷-聚乙二醇-聚乙二醇(PSMA-PEG)之間的疏水-疏水相互作用進行自組裝。TEM圖像顯示,FeCORM NPs呈球形,尺寸為~60納米。通過動態光散射測量FeCORM NPs的平均流體動力學直徑為65±2 nm。納米顆粒表面帶負電荷,測量電位為?33.2±3.4 mV。帶負電的表面確保了膠體系統在水中的高穩定性。通過監測長達14天的流體動力學直徑,其在鹽水和水中的長期穩定性得以保持。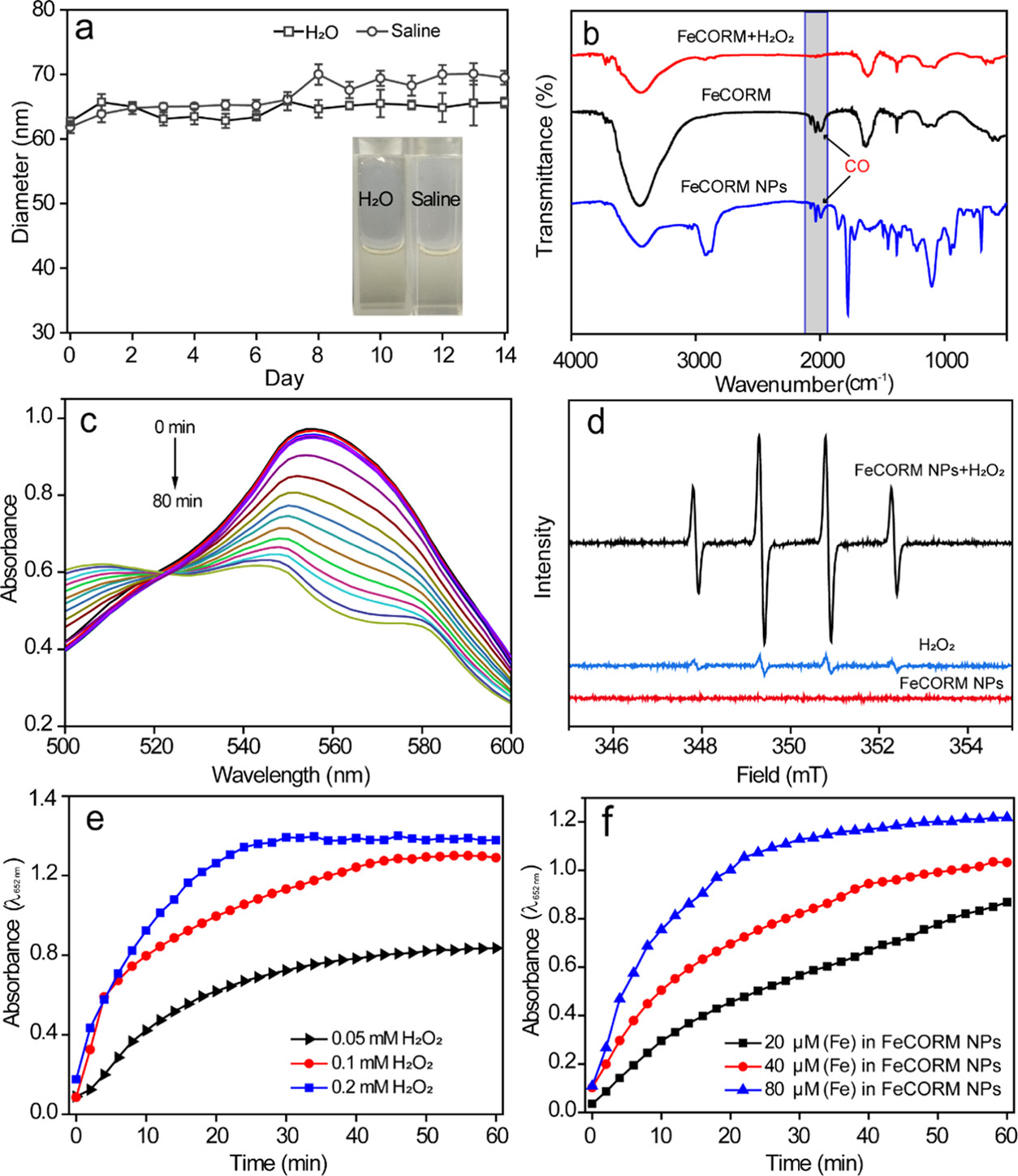
在目前的系統中,GSH確實被用于促進FeCORM NPs的CO釋放,這是使用以肌紅蛋白(Mb)為探針的紫外-可見光譜法進行監測的。在540和577 nm處出現了兩條新的吸收帶,表明由于FeCORM NPs釋放CO而形成MbCO。在存在10 mM GSH的情況下,納米顆粒的CO釋放在50 min內完成。除了TME中相對較高濃度的GSH外,還存在H2O2,每104個細胞每小時的H2O2濃度高達0.5 nmol。H2O2的存在確實觸發了CO釋放。在存在H2O2的情況下,納米顆粒的尺寸在24小時內變大,這可能是由于釋放CO導致納米顆粒結構的變化。。這種H2O2響應機制不像GSH觸發的CO釋放那樣通過配體交換,而是通過金屬中心的氧化。XPS數據證實了FeCORM NPs和H2O2混合物中存在Fe(II)。考慮到CO釋放過程中產生的Fe(II)物種以及H2O2的存在,可能會發生Fenton反應。我們使用3,3′,5,5′-四甲基聯苯胺(TMB)作為探針來檢測其Fenton活性。FeCORM NPs和H2O2在pH 5.2下的混合物以及5,5-二甲基-1-吡咯啉氧化物(DMPO)作為自由基捕獲劑,以1:2:2:1的特征比產生電子自旋共振(ESR)信號,這表明捕獲的自由基是羥基自由基(?OH)。?OH的生成取決于FeCORM NPs和H2O2的濃度以及反應時間。這些結果表明,FeCORM NPs在釋放CO時對GSH和H2O2都有反應。H2O2引發的CO釋放也伴隨著通過Fenton反應生成?OH,自由基可能在CDT中具有潛在用途。
為了評價FeCORM-NPs在體外的治療效果,我們使用了以下兩種細胞系:癌細胞(B16-F10)和正常細胞(HUVEC)。通過MTT試驗獲得的細胞存活率,在B16-F10和HUVEC的IC50值分別為45.4和72.6μM的情況下,納米平臺在孵育24小時后在癌細胞和正常細胞之間顯示出一定程度的分化。為了確定過氧化氫和谷胱甘肽在體外是否都能誘導CO釋放,并隨后產生ROS,從而損傷所檢測的B10-F10細胞,分別使用L-丁硫氨酸-亞砜肟(L-BSO)和過氧化氫酶(CAT)抑制細胞中的GSH和H2O2,然后定量分析B16-F10細胞的存活率。所有細胞用Annexinv-FITC/PI凋亡試劑盒標記,流式細胞儀分析。L-BSO+CAT+FeCORM NPs組的細胞存活率高達95.6%,而僅與FeCORM NPs孵育的細胞存活率為31.5%。無論是單用L-BSO還是單用CAT,存活率都有顯著提高,分別為88.9%和67.6%,這是由于CAT和L-BSO抑制H2O2和GSH所致。這些數據表明,細胞內H2O2和GSH是導致細胞活力低下的主要因素。GSH和H2O2都引發了鐵羰基化合物的分解,在此期間,Fe(II)和H2O2共存將通過Fenton反應途徑生成ROS,細胞死亡可以合理地歸因于ROS自由基和靶向線粒體釋放的CO。
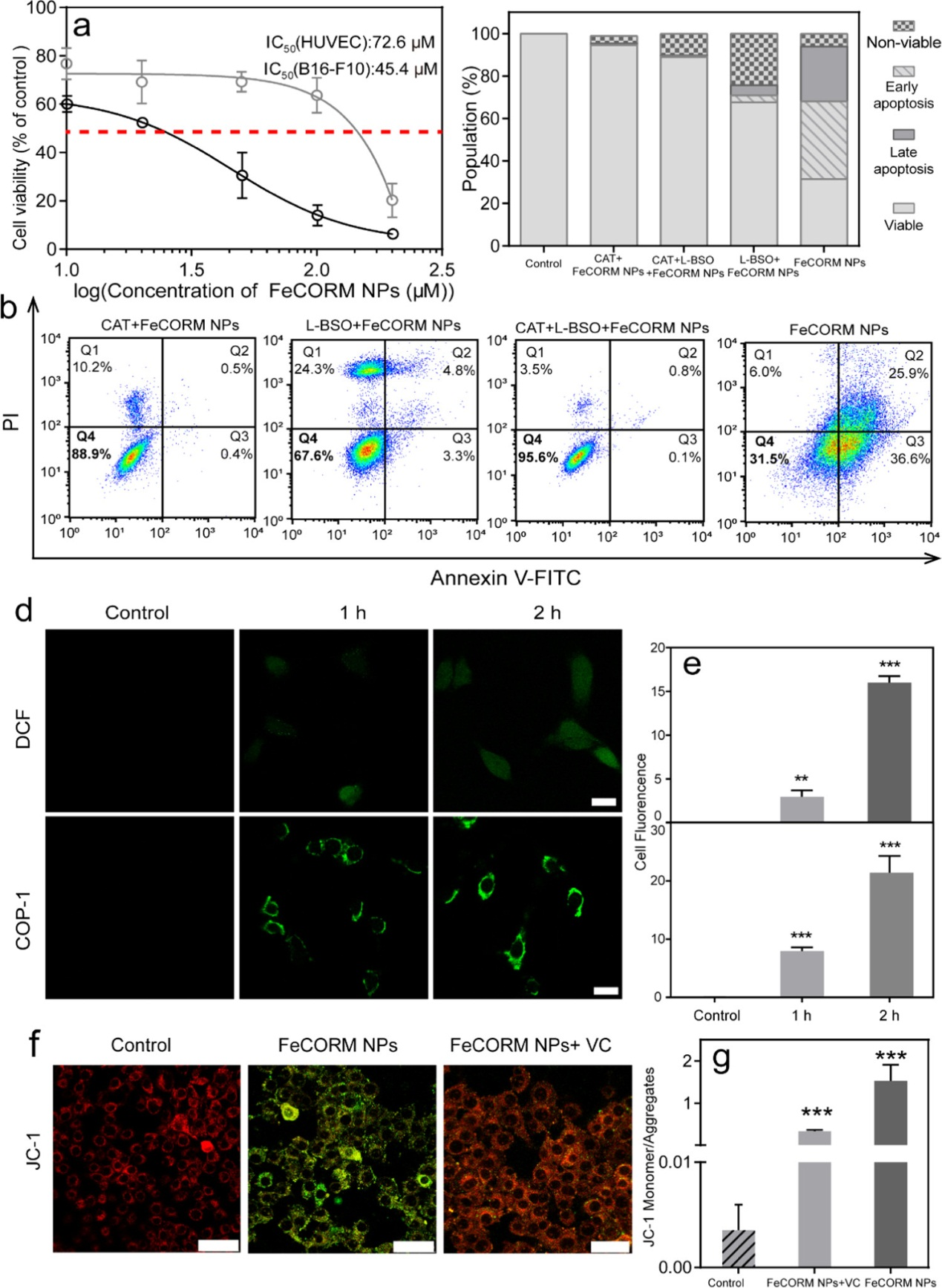
共焦激光掃描顯微鏡(CLSM)和流式細胞術檢測細胞內ROS和CO。使用ROS檢測試劑盒(2′,7′-二氯熒光素,DCF探針)和CO探針(COP-1)檢測存在FeCORM NPs時產生的細胞內ROS和CO。如熒光強度所示,由FeCORM NPs產生的ROS和CO的細胞內數量隨著培養時間的延長而增加。在延長培養時間后,流式細胞術的結果也觀察到相同的熒光強度變化趨勢。線粒體膜電位探針JC-1被用于評估FeCORM NPs誘導的細胞線粒體損傷。對照組細胞線粒體中的JC-1呈聚合物形式,顯示明亮的紅色熒光。當存在FeCORM NPs時,由于B16-F10細胞的線粒體膜電位降低,JC-1不能作為聚合物存在于線粒體基質中。因此,線粒體中的紅色熒光強度顯著減弱,而細胞質中的綠色熒光強度顯著增強,這表明線粒體受到嚴重損傷。通過添加ROS清除劑(VC)來抑制細胞內的ROS水平,從而大大恢復了明亮的紅色熒光,表明細胞線粒體損傷顯著減少,從而進一步證明了由于存在FeCORM NPs而導致的細胞內ROS及其對線粒體的損傷。對照組、FeCORM NPs組和FeCORM NPs+VC組的綠色和紅色熒光強度比分別為0.004、1.5和0.3,定量顯示了納米平臺造成的線粒體損傷。
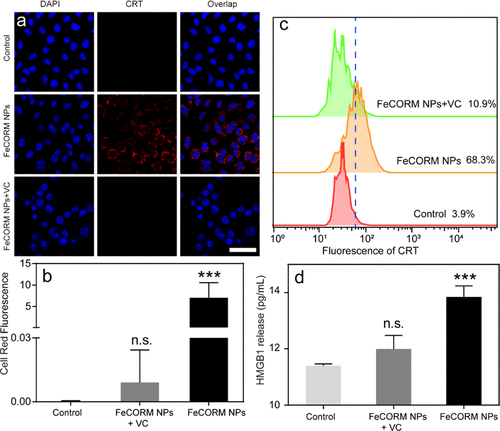
為了研究FeCORM NPs引發的ICD,評估了經FeCORM NPs處理24小時的B16-F10細胞中CRT暴露水平和HMGB1釋放。CLSM和流式細胞術用于檢測細胞表面CRT暴露。在FeCORM NPs處理組中觀察到代表細胞表面CRT的鮮紅色熒光,而當添加ROS清除劑(VC)時,紅色熒光消失,表明癌細胞表面CRT表達受到抑制。結果有力地證明了活性氧誘導的CRT細胞表面易位。流式細胞術也獲得了相同的結果。此外,通過酶聯免疫吸附試驗(ELISA)分析HMGB1的釋放。與對照組和FeCORM NPs+VC組相比,FeCORM NP組顯著提高了B16-F10細胞HMGB1的釋放。因此,FeCORM NP介導的CDT可以在B16-F10細胞中誘導ICD。
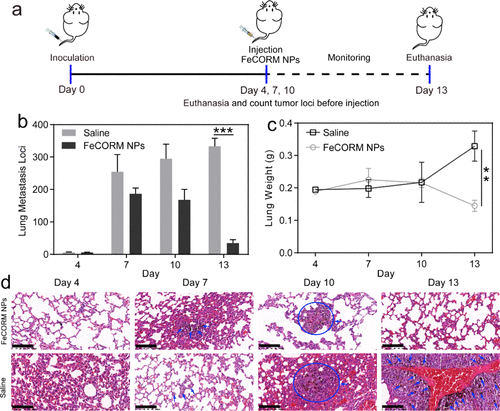
我們進一步評估了FeCORM NPs的體內性能。通過靜脈注射5×105 B16-F10黑色素瘤細胞在免疫活性BALB/c小鼠中構建黑色素瘤肺轉移模型。第4天,通過尾靜脈向小鼠注射FeCORM NPs懸浮液。每三天注射一次,對照組同樣注射生理鹽水。在第4天、第7天、第10天和第13天,在下一次注射之前移除荷瘤小鼠的肺,然后計算肺轉移位點,并在對小鼠實施安樂死后拍攝照片。第4天,肺轉移未完全形成,因為對照組和使用FeCORM NPs的治療組之間沒有顯著差異。第7天,治療組的肺轉移位點數(186.7±18.0)比對照組(254.7±52.9)低約30%。在接下來的三天內,治療組(168.3±31.7)和對照組(294.7±45.1)均未觀察到顯著變化。然而,進一步的治療顯示出顯著的差異,因為在第13天,治療組的肺轉移位點數量迅速下降至34.7±10.5,而對照組的肺轉移位點數量(333.3±24.5)比FeCORM NPs組高10倍。結果表明,FeCORM NPs顯著抑制黑色素瘤肺轉移的生長。小鼠平均肺重量的變化也證明了治療的效果。與第4天的平均肺重量相比,治療組的平均肺重量下降了約25%,而由于黑色素瘤肺轉移的增長,對照組的平均肺重量在第13天增加了50%以上。此外,各組肺部的蘇木精和曙紅(H&E)以及HMGB1染色圖像。用藍色箭頭或圓圈突出顯示的區域代表肺轉移區域。這些結果與肺轉移位點的計算結果一致。所有這些結果都表明FeCORM NPs可以抑制肺轉移。對肺轉移的神奇抑制可能不僅歸因于CDT,還與小鼠免疫系統的激活有關。
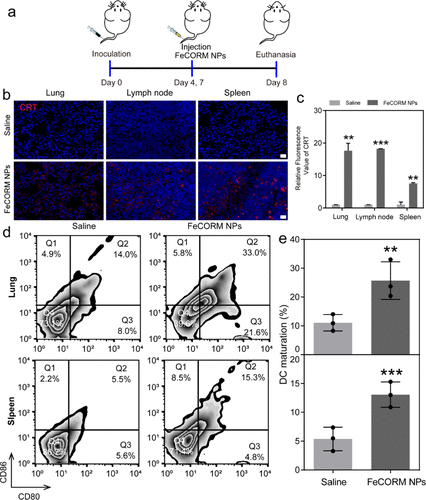
如上所述,我們認為納米平臺對黑色素瘤肺轉移的療效可能部分來自于激活小鼠的免疫反應。在第8天對荷瘤小鼠實施安樂死后,收集荷瘤小鼠的肺、引流淋巴結和脾臟。通過對肺、引流淋巴結和脾臟的CRT染色檢查CRT暴露。細胞核區域發出藍色熒光,細胞膜上的CRT曝光呈紅色。使用ImageJ計算CRT的平均熒光強度,FeCORM NPs組在肺、引流淋巴結和脾臟中的紅色熒光強度比分別為17.6±2.3、18.2±0.04和7.6±0.2。這些結果表明,由于在**區域有效積累FeCORM NPs,導致CRT暴露顯著,從而誘發ICD。眾所周知,CRT暴露(DAMP之一)是DC成熟的關鍵刺激。通過使用流式細胞術分析第8天從荷瘤小鼠肺和脾臟獲得的DC成熟的兩個生物標記物(CD80和CD86)來評估DC成熟。與對照組相比,FeCORM NPs治療組的DC成熟率在肺和脾臟都增加了一倍以上。這些結果堅定地證明了FeCORM NPs介導的CDT通過ICD誘導抗**免疫反應的效力,以及CRT暴露的增加和DC在體內的成熟,這使得納米平臺具有抗黑色素瘤肺轉移的強大功效。
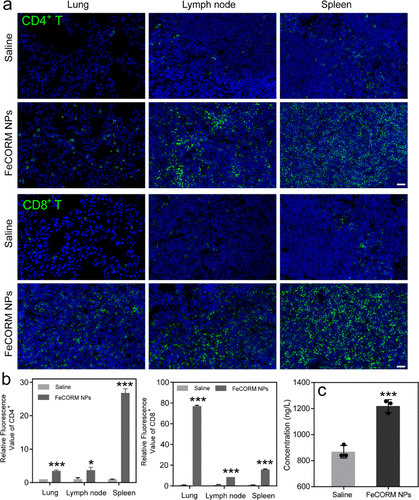
活化的DC可進一步促進**組織周圍T淋巴細胞的募集和分化。用免疫熒光染色法對患有黑色素瘤肺轉移的小鼠的CD8 T和CD4 T細胞水平進行了研究。綠色熒光強度形成鮮明對比,表明對照組和FeCORM NPs治療組之間的CD4和CD8 T細胞水平。兩種類型T細胞的定量分析表明,與生理鹽水組相比,治療組的所有三種組織都顯著增加,盡管這些組織中的分化增加。與對照組相比,肺中的細胞毒性CD8 T細胞幾乎增加了80倍,而脾臟中的CD4 T細胞幾乎增加了30倍;在使用FeCORM NPs治療后,三種組織中觀察到最顯著的增加。對于其余的組織,兩個T細胞從幾倍增加到大約30倍。這些結果表明,納米材料引發了小鼠的整體免疫反應,以產生強大的抗**T細胞。ICD誘導的這些免疫反應進一步刺激了適應性免疫反應,包括免疫促進細胞因子(如TNF-α)的產生,用ELISA評估**中的TNF-α水平,FeCORM NPs組(1220.2±40.2 ng/L)顯著高于生理鹽水組(754.1±165.9 ng/L)。增加的細胞因子進一步增強了納米材料抗**細胞的功效。結果很好地證明了ICD是細胞死亡的途徑之一,因此證明了納米平臺FeCORM NPs對黑色素瘤肺轉移的活性。
結論
我們構建了一種新型TME反應性納米平臺FeCORM NPs,用于包括CO、CDT和ICD觸發的IMT在內的聯合治療。在TME中,GSH和H2O2引發了納米平臺FeCORM NPs的CO釋放,在此過程中還生成了亞鐵鹽,可引發一系列細胞內活性,協同抑制黑色素瘤的肺轉移。FeCORM NPs介導的CDT誘導基于ICD的抗**免疫反應,**細胞DAMP釋放增加,成熟DC比例增加,激活了**中的T淋巴細胞。體外和體內研究均證實了其對**的有效作用。參考文獻
Tumor Microenvironment-Activated Nanoparticles Loaded with an Iron-Carbonyl Complex for Chemodynamic Immunotherapy of Lung Metastasis of Melanoma In Vivo, Tianli Zhai, Wei Zhong, Yucong Gao, Han Zhou, Zhiguo Zhou, Xiaoming Liu*, Shiping Yang, and Hong Yang*, Angew. ACS Appl. Mater. Interfaces 2021, 13, 33, 39100–39111
產品提供
| 序號 | 新聞標題 | 瀏覽次數 | 作者 | 發布時間 |
|---|---|---|---|---|
| 1 | 瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine | 807 | 瑞禧生物 | 2022-11-09 |
| 2 | 科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne | 830 | 瑞禧生物 | 2022-11-09 |
| 3 | 胺基與NHS活性酯反應PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物 | 1597 | 瑞禧生物 | 2023-01-03 |
| 4 | 瑞禧2023更新 Azido-PEG8-acid疊氮八聚乙二醇羧酸 | 735 | 瑞禧生物 | 2023-01-03 |
| 5 | 嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL | 839 | 瑞禧生物 | 2022-12-08 |
| 6 | 活性氧敏感聚合物TK-PPE 酮縮硫醇-聚磷酸酯 PPE-TK | 890 | 瑞禧生物 | 2022-12-08 |
| 7 | 功能化腙鍵響應性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽 | 869 | 瑞禧生物 | 2022-12-08 |


 400-115-0588
400-115-0588 在線咨詢
在線咨詢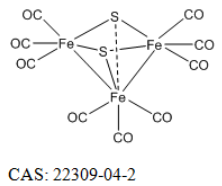








 庫存查詢
庫存查詢